FÍSICO-QUÍMICA 8º ANO
Teoria corpuscular e representação de reações químicas
EXPLICAÇÃO E REPRESENTAÇÃO DE REAÇÕES QUÍMICAS
NATUREZA CORPUSCULAR DA MATÉRIA
Corpúsculos
Teoria corpuscular da matéria
- Todas as substâncias são constituídas por pequeníssimos corpúsculos que estão em constante movimento, entre os quais existe espaço vazio.
Tipos de corpúsculos:
- átomos
- moléculas
- iões
Liberdade de movimento dos corpúsculos
- As substâncias podem-se encontrar nos estados sólido, líquido ou gasoso. O comportamento dos corpúsculos em cada estado físico é diferente:
- No estado sólido:
- Os corpúsculos encontram-se juntos e organizados
- As forças de ligação são fortes
- Existe pouca liberdade de movimento
- No estado sólido:
- No estado líquido:
- Os corpúsculos encontram-se mais afastados uns dos outros
- As forças de ligação são mais fracas
- Existe alguma liberdade de movimento
- No estado gasoso:
- Os corpúsculos encontram-se afastados e desorganizados
- As forças de ligação são muito fracas
- Existe grande liberdade de movimento

Efeito da temperatura no comportamento dos corpúsculos:
- Quanto maior a temperatura, maior a agitação dos corpúsculos.
Como a temperatura provoca a alteração do comportamento dos corpúsculos de uma determinada substância, poderá provocar também a mudança do seu estado físico.
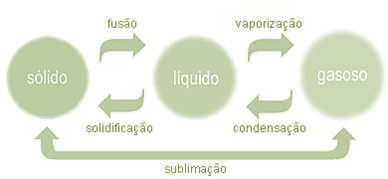
Forma e volume das substâncias
A forma e o volume das substâncias podem variar ou não, conforme o seu estado físico.

Pressão de um gás
A pressão de um gás corresponde à intensidade da força que os corpúsculos exercem, por unidade de área, na superfície do recipiente onde estão contidos.

Variações de temperatura, pressão e volume:
- Para o mesmo volume, quanto maior a temperatura maior a pressão de um gás
- Para a mesma temperatura, quanto menor o volume maior a pressão de um gás
- Para o mesmo volume e mesma temperatura, quanto maior o número de corpúsculos de um gás maior é a pressão que exerce
ÁTOMOS
Constituição de um átomo
Um átomo é constituído por:
- um núcleo: formado por protões e neutrões
- uma nuvem eletrónica: formada pelos eletrões, que circulam à volta do núcleo
Carga elétrica das partículas subatómicas:
- protões: carga elétrica positiva
- neutrões: carga elétrica neutra
- eletrões: carga elétrica negativa

Carga elétrica de um átomo:
- neutra, pois o número de protões é sempre igual ao número de eletrões.
Massa de um átomo
A massa de um átomo concentra-se quase toda no núcleo, pois a massa de um eletrão é desprezável quando comparada com a de um protão ou a de um neutrão.
Elementos químicos e símbolos químicos
Os átomos que são do mesmo tipo (têm o mesmo número de protões) dizem-se que são do mesmo elemento químico. Cada elemento químico é representado por um símbolo químico universal.

MOLÉCULAS
Fórmula química de uma molécula
- Molécula:
- conjunto de átomos interligados entre si
- unidade estrutural das substâncias
- eletricamente neutra
- representa-se por uma fórmula química com os símbolos químicos dos elementos químicos dos átomos que a constituem

O2 – Molécula de di-oxigénio
- Composição quantitativa:
- Molécula formada por 2 átomos
- Composição qualitativa:
- Molécula formada por 2 átomos de oxigénio
A molécula formada por 2 átomos de oxigénio representa a unidade estrutural de uma substância elementar, pois é constituída por átomos do mesmo elemento químico.

H2O – Molécula de água
- Composição quantitativa:
- Molécula formada por 3 átomos
- Composição qualitativa:
- Molécula formada por 2 átomos de hidrogénio e 1 de oxigénio
A molécula formada por 2 átomos de hidrogénio e 1 átomo de oxigénio representa a unidade estrutural de uma substância composta, pois é constituída por átomos de elementos químicos diferentes.


2 CO2 – 2 Moléculas de dióxido de carbono
- Composição quantitativa:
- 2 moléculas formadas cada uma por 3 átomos
- Composição qualitativa:
- 2 moléculas formadas cada uma por 1 átomo de carbono e 2 átomos de oxigénio
O número antes da fórmula química indica o número de moléculas.
IÕES
Anião e catião
Formação de iões:
- ião negativo (anião): átomo, ou grupo de átomos, que captou um ou mais eletrões
- ião positivo (catião): átomo, ou grupo de átomos, que cedeu um ou mais eletrões
Fórmula química de um ião:
- Um ião é representado por uma fórmula química com os símbolos químicos dos átomos que lhe deram origem, e pela carga do ião.

Substâncias iónicas
- Substância iónica:
- constituída pela junção de aniões e catiões
- é eletricamente nula, pois tem igual número de cargas negativas e de cargas positivas.
Escrever a fórmula química de uma substância iónica:
- em português, lê-se primeiro o ião negativo e depois o ião positivo
- no entanto, ao escrever a fórmula química da substância iónica, coloca-se primeiro a fórmula do ião positivo e só depois a do ião negativo
- sendo uma substância eletricamente neutra, temos de igualar as cargas positivas e negativas, se necessário
No caso do Cloreto de Cálcio, são necessários dois iões de Cloreto para um de Cálcio.
Ca2+ + 2 Cl– → CaCl2
REPRESENTAÇÃO DE REAÇÕES QUÍMICAS
Conservação da massa
Numa reação química há rearranjos dos átomos dos reagentes que conduzem à formação de novas substâncias, conservando-se o número total de átomos de cada elemento. Sendo assim, verifica-se que, durante uma reação química, a massa dos reagentes diminui e a massa dos produtos aumenta, verificando-se uma conservação da massa.
- Lei de Lavoisier ou Lei da Conservação da Massa
- Numa reação química não há variação de massa, ou seja, a massa total dos reagentes é igual à massa total dos produtos da reação
Equações de palavras e equações químicas
As reacções químicas podem ser traduzidas por equações de palavras ou por equações químicas.
Combustão do hidrogénio
- Equação de palavras:
Oxigénio (g) + Hidrogénio (g) → Água (l)
- Equação química:
O2 (g) + H2 (g) → H2O (l)

Para escrever uma equação química utilizamos as fórmulas químicas das substâncias intervenientes da reacção química e temos de aplicar a lei da conservação da massa, ou seja, o número total de átomos de casa elemento tem de se manter igual. Como verificamos no quadro acima, tal não se verifica, e por isso, temos ainda de acertar a equação.
O2 (g) + 2 H2 (g) → 2 H2O (l)

São necessárias 2 moléculas de hidrogénio para uma de oxigénio, para formar 2 moléculas de água.
Revê aqui a matéria/resumo/síntese de CFQ:
VÍDEOS
Lista com 17 vídeos. Para navegar entre os vários vídeos clicar na parte superior direita do player.
EXERCÍCIOS
Ficha 1 | Átomos e moléculas | enunciado » resolução
Ficha 2 | Símbolos químicos | enunciado » resolução
Ficha 3 | Escrita de fórmulas químicas | enunciado » resolução
Ficha 4 | Lei de Lavoisier | enunciado » resolução
Ficha 5 | Acerto de equações | enunciado » resolução
Ficha 6 | Natureza corpuscular da matéria | enunciado » resolução
Ficha 7 | Os estados físicos e a agregação corpuscular | enunciado » resolução
Ficha 8 | Substâncias elementares e substâncias compostas | enunciado » resolução
Ficha 9 | Fórmulas químicas de substâncias moleculares | enunciado » resolução
Ficha 10 | Fórmulas químicas de substâncias iónicas| enunciado » resolução
Ficha 11 | Reações químicas que ocorrem à nossa volta | enunciado » resolução
Ficha 12 | Lei da Conservação da Massa | enunciado » resolução
Ficha 13 | Equações químicas | enunciado » resolução
O que tens de saber neste capítulo, segundo o programa e metas curriculares de Ciências Físico-Químicas – 8º ano:
DOMÍNIO: REAÇÕES QUÍMICAS
SUBDOMÍNIO: EXPLICAÇÃO E REPRESENTAÇÃO DE REAÇÕES QUÍMICAS
- Reconhecer a natureza corpuscular da matéria e a diversidade de materiais através das unidades estruturais das suas substâncias; compreender o significado da simbologia química e da conservação da massa nas reações químicas
- Indicar que a matéria é constituída por corpúsculos submicroscópicos (átomos, moléculas e iões) com base na análise de imagens fornecidas, obtidas experimentalmente.
- Indicar que os átomos, moléculas ou iões estão em incessante movimento existindo espaço vazio entre eles.
- Interpretar a diferença entre sólidos, líquidos e gases com base na liberdade de movimentos e proximidade entre os corpúsculos que os constituem.
- Associar a pressão de um gás à intensidade da força que os corpúsculos exercem, por unidade de área, na superfície do recipiente onde estão contidos.
- Relacionar, para a mesma quantidade de gás, variações de temperatura, de pressão ou de volume mantendo, em cada caso, constante o valor de uma destas grandezas.
- Descrever a constituição dos átomos com base em partículas mais pequenas (protões, neutrões e eletrões) e concluir que são eletricamente neutros.
- Indicar que existem diferentes tipos de átomos e que átomos do mesmo tipo são de um mesmo elemento químico, que se representa por um símbolo químico universal.
- Associar nomes de elementos a símbolos químicos para alguns elementos (H, C, O, N, Na, K, Ca, Mg, Al, Cl, S).
- Definir molécula como um grupo de átomos ligados entre si.
- Descrever a composição qualitativa e quantitativa de moléculas a partir de uma fórmula química e associar essa fórmula à representação da substância e da respetiva unidade estrutural.
- Classificar as substâncias em elementares ou compostas a partir dos elementos constituintes, das fórmulas químicas e, quando possível, do nome das substâncias.
- Definir ião como um corpúsculo com carga elétrica positiva (catião) ou negativa (anião) que resulta de um átomo ou grupo de átomos que perdeu ou ganhou eletrões e distinguir iões monoatómicos de iões poliatómicos.
- Indicar os nomes e as fórmulas de iões mais comuns (Na+ , K+ , Ca2+, Mg2+, Al3+ , NH4 + , Cl– , SO4 2- , NO3 – , CO3 2- , PO4 3- , OH– , O2- )
- Escrever uma fórmula química a partir do nome de um sal ou indicar o nome de um sal a partir da sua fórmula química.
- Concluir, a partir de representações de modelos de átomos e moléculas, que nas reações químicas há rearranjos dos átomos dos reagentes que conduzem à formação de novas substâncias, conservando-se o número total de átomos de cada elemento.
- Indicar o contributo de Lavoisier para o estudo das reações químicas.
- Verificar, através de uma atividade laboratorial, o que acontece à massa total das substâncias envolvidas numa reação química em sistema fechado.
- Concluir que, numa reação química, a massa dos reagentes diminui e a massa dos produtos aumenta, conservando-se a massa total, associando este comportamento à lei da conservação da massa (lei de Lavoisier).
- Representar reações químicas através de equações químicas, aplicando a lei da conservação da massa.
Todos os capítulos do programa de Ciências Físico-Químicas – 8º ano:
DOMÍNIO: REAÇÕES QUÍMICAS
- Explicação e representação das reações químicas
- Tipos de reações químicas
- Velocidade das reações químicas
DOMÍNIO: SOM
- Produção e transmissão do som
- Som e ondas
- Atributos do som e a sua deteção pelo ser humano
- Fenómenos acústicos
DOMÍNIO: LUZ
